This article is from ECHO Asia Note #27
ที่มา
ตั้งแต่เดือนกันยายน ถึงพฤศจิกายน ปี 2557 และอีกครั้งในเดือนกรกฏาคมและสิงหาคม ปี 2558 เอคโค เอเชียได้ผลิตและทดสอบน้ำยากำจัดวัชพืชโดยใช้ส่วนผสมที่มีอยู่ตามท้องถิ่น โดยจัดทำขึ้นที่ธนาคารเมล็ดพันธุ์เอคโค เอเชียที่อำเภอแม่อาย (ดูสารเอคโค เอเชีย ฉบับที่ 26: “การทำและการทดสอบน้ำยากำจัดวัชพืชทางเลือกสำหรับนำไปใช้ในเกษตรกรรายย่อย”) ที่ได้แสดงถึงประสิทธิภาพในการควบคุมปริมาณวัชพืชในแปลงทดลอง โดยน้ำยากำจัดวัชพืชนี้ประกอบไปด้วยมะละกอสุกหรือสับปะรด, เกลือ และโซดาไฟ (ที่มีฤทธิ์เป็นด่างสูง) เราต้องการทดสอบดูว่าการฉีดพ่นน้ำยาที่มีฤทธิ์เป็นด่างจะมีผลอย่างไรบ้างต่อค่าpHในดิน โครงสร้างของดิน ความแข็งแรงของพืชที่ปลูกและปริมาณความหนาแน่นของจุลินทรีย์ มีนักวิทยาศาสตร์บางคนพบว่าปัจจัยที่ใช้ในการเกษตรเช่นน้ำยากำจัดศัตรูพืชและเชื้อรากำจัดศัตรูพืชมีผลต่อการเปลี่ยนแปลงปริมาณจุลินทรีย์ เนื่องจากความเสถียรของปริมาณพืชขนาดเล็กในดิน (soil microflora)เป็นสิ่งที่สำคัญมากต่อขบวนการต่างๆเช่น วัฎจักรของธาตุอาหารและการเกิดเม็ดดิน(aggregation) เราจึงต้องเฝ้าติดตามความเปลี่ยนแปลงที่อาจเกิดขึ้นได้ต่อสิ่งมีชีวิตที่มีประโยชน์เหล่านี้ อย่างไรก็ตามการทดสอบปริมาณจุลินทรีย์มักจะต้องปฏิบัติการในห้องทดลองและมีค่าใช้จ่ายสูง เอคโค เอเชียจึงพยายามทดลองจัดทำเกณฑ์วิธีที่เหมาะสม ใช้งานได้จริง และมีประโยชน์ในการเฝ้าดูการเปลี่ยนแปลงปริมาณประชากรจุลินทรีย์ในดิน
คำนำ
จุลินทรีย์หมายถึงสิ่งมีชีวิตทุกชนิดที่มีขนาดเล็กเกินกว่าที่ตามองเห็น ได้แก่ เชื้อรา, สาหร่าย และแบคทีเรีย (Rao, 1995) สิ่งมีชีวิตขนาดเล็กเหล่านี้พบได้ทุกหนทุกแห่ง ไม่ว่าจะเป็นในน้ำ ในอากาศ และในดิน โดยในพื้นที่การเกษตร ปริมาณจุลินทรีย์จะมีอยู่มากเป็นพิเศษในปุ๋ยหมัก มูลสัตว์ และน้ำจุลินทรีย์ IM (ย่อมาจาก Indigenous Microorganisms หรือ จุลินทรีย์ในท้องถิ่น) หรือน้ำจุลินทรีย์ EM (ย่อมาจาก Effective Microorganisms หรือจุลินทรีย์ที่มีประสิทธิภาพ) จุลินทรีย์เป็นส่วนประกอบที่สำคัญของดิน เพราะทำหน้าที่ช่วยย่อยสลายอินทรีย์วัตถุ ขณะเดียวกันยังช่วยเปลี่ยนสภาพสารอาหารที่มีอยู่ในหินและในอากาศให้พืชนำไปใช้ได้ และเป็นตัวช่วยในการเกาะกลุ่มของอนุภาคดิน (Tisdall, 1994; Hayat et al. 2010) นอกจากนั้นจุลินทรีย์ในดินยังมีบทบาทสำคัญต่อความแข็งแรงของพืชที่ปลูก เพราะมีส่วนช่วยในวัฎจักรธาตุอาหาร ย่อยสลายน้ำยากำจัดศัตรูพืช และถ้าในดินมีจุลินทรีย์ที่มีประโยชน์อยู่จำนวนมากก็จะลดปริมาณโรคพืชที่เกิดจากแบคทีเรีย (Anderson, 1984; Mendes et al., 2011)
ความแข็งแรงและปริมาณของจุลินทรีย์ขึ้นอยู่กับปัจจัยหลายอย่าง ได้แก่ ค่าpHของดิน, ปริมาณความชื้นในดิน, อุณหภูมิ, ความเค็ม, ปริมาณออกซิเจน และอินทรีย์วัตถุ (Schnürer et al., 1986; Matthias et al., 1995; Graeme et al., 2008; Tourna et al., 2008) นอกจากนี้สิ่งที่ใช้ในพื้นที่การเกษตร เช่น มูลสัตว์ ปุ๋ยหมัก น้ำIM, ปุ๋ย, ยาฆ่าเชื้อราและยาฆ่าแมลงก็มีผลต่อปริมาณและชนิดของจุลินทรีย์ที่อยู่ในดินด้วย (Bünemann et al., 2005)
จุลินทรีย์มักจะพบได้ตามชั้นส่วนบนของดินเช่น ดินชั้นบนและหน้าดิน โดยพื้นที่นี้เป็นส่วนที่ต้องสัมผัสกับน้ำยากำจัดศัตรูพืช, ปุ๋ย, ยาฆ่าแมลงและยังสัมผัสกับส่วนที่เป็นสารอินทรีย์พวกใบไม้ มูลสัตว์ ปุ๋ยหมัก และน้ำ IM ทั้งนี้จุลินทรีย์ส่วนใหญ่จะชอบอยู่ในดินที่มีค่าpHประมาณ 5-7 (ใกล้เคียงกับค่าpH ของน้ำ) ความผันผวนของค่าpHในดินยังสามารถเปลี่ยนโครงสร้างสิ่งมีชีวิตในดินด้วย (Lauber et al., 2009) ดินในเขตร้อนชื้นมักจะมีค่าเป็นกรดมากกว่า (ส่วนใหญ่มีค่าpH ที่ 4-5) ดังนั้นจุลินทรีย์ที่ชอบดินที่เป็นกรดก็จะเพิ่มจำนวนและรวมตัวกันอยู่ในพื้นที่นั้น สิ่งที่จำเป็นต่อจุลินทรีย์ได้แก่ คาร์บอน, ออกซิเจน, ไนโตรเจน, โปตัสเซียม, แมกนีเซียม, แมงกานีส, เหล็ก และไอออนอื่นๆในปริมาณน้อยกว่า และจุลินทรีย์จะได้รับธาตุอาหารที่จำเป็นส่วนมากจากการย่อยสลายสิ่งที่ตายแล้วหรือจากการกินกันเอง จุลินทรีย์จะชอบอาศัยในดินที่มีรูพรุนและมีอินทรีย์วัตถุปริมาณมากเพื่อจะมีอาหาร น้ำและออกซิเจนที่เพียงพอ (Hassink, 1993)
ความเค็มของดินเป็นตัววัดปริมาณของเกลือที่อยู่ในดิน ได้แก่โซเดียม, แมกนีเซียม, แคลเซียม, ซัลเฟต และไบคาร์บอเนต ภาวะที่มีความเค็มมากอาจลดความสามารถในการเผาผลาญของจุลินทรีย์ (Rietz & Haynes, 2003) การรุกล้ำของน้ำเค็มที่เข้ามาอาจเกิดขึ้นได้ในพื้นที่ที่ติดกับที่ลุ่มน้ำเค็ม น้ำกร่อย หรือทะเล การเปลี่ยนแปลงอื่นๆที่ทำให้องค์ประกอบที่เป็นเกลือในดินเพิ่มขึ้นอาจส่งผลให้เกิดการเปลี่ยนแปลงของระดับน้ำใต้ดิน รวมถึงการใช้ปุ๋ยบางอย่างอาจทำให้จุลินทรีย์อ่อนแอลงและลดปริมาณลงด้วย
ในพื้นที่ที่มีประวัติการใช้งานมานานอาจส่งผลกระทบต่อปริมาณจุลินทรีย์ในดินเป็นเวลานานด้วย ปัจจัยต่างๆเช่นระดับค่าpH, ความเค็ม,และสารตกค้างจากยาฆ่าแมลงจะยังคงอยู่ในดินและยากต่อการปรับปรุงดินให้ดีขึ้น ปัจจัยหลายๆอย่างที่เป็นผลต่อความแข็งแรงของกลุ่มจุลินทรีย์ทำให้ยากที่จะเจาะจงว่าปัญหานั้นเกิดจากปัจจัยใดแน่ อย่างไรก็ตาม การเฝ้าติดตามจำนวนจุลินทรีย์ในพื้นที่ทำการเกษตรยังถือเป็นเรื่องที่สำคัญ โดยเฉพาะเมื่อมีการทดลองใช้เทคนิคและเทคโนโลยีใหม่ๆ บทความนี้จะอธิบายถึงทางเลือกต่างๆในการเฝ้าติดตามจำนวนจุลินทรีย์ในดิน ด้วยวิธีการที่ประหยัดค่าจ่ายกว่าการนำไปทดสอบในห้องทดลอง
ความหนาแน่นของประชากรจุลินทรีย์ในดินมีความสัมพันธ์กับการย่อยสลายและการหายใจของดิน จึงอาจพูดได้ว่ายิ่งความหนาแน่นของจุลินทรีย์มีมาก เมื่อถึงจุดหนึ่งจะสามารถย่อยสลายอินทรีย์วัตถุได้รวดเร็วมากกว่าจุลินทรีย์ในดินที่มีปริมาณน้อยกว่า จำนวนประชากรของพืชขนาดเล็กที่สะสมอยู่ในดินใช้เป็นตัวชี้วัดถึงมลสารในดิน (Van Bruggen & Semenov, 2000) เนื่องจากวัฎจักรของธาตุอาหารที่ประกอบไปด้วยขบวนการย่อยสลายมีผลอย่างมากต่อคุณภาพของดิน และจุลินทรีย์เหล่านี้มีส่วนช่วยในขบวนการนี้ เราจำเป็นต้องเฝ้าติดตามการเปลี่ยนแปลงขนาดประชากรจุลินทรีย์ที่เป็นผลจากการใช้ยาหรือปุ๋ยใหม่ๆ ที่เราเป็นห่วงที่สุดคือว่าน้ำยากำจัดศัตรูพืชจะเป็นอันตรายต่อจุลินทรีย์และทำให้ปริมาณจุลินทรีย์ลดลง ข้อมูลตัวเลขที่ได้นี้จะแสดงปริมาณที่ลดลงถ้ากระดาษกรองในแปลงที่ฉีดพ่นด้วยน้ำยาเน่าเปื่อยช้ากว่าแปลงที่ถูกฉีดด้วยน้ำ
[บก.: เอคโค เอเชียใช้วิธีการต่อไปนี้เพื่อทดสอบผลกระทบที่เกิดจากน้ำยากำจัดศัตรูพืชจากธรรมชาติที่ทำขึ้นเอง เราเปรียบเทียบน้ำยาสับปะรถ, น้ำยามะละกอ และน้ำเปล่า ข้อมูลสำหรับผู้อ่านคือพื้นที่ทดลองแบ่งออกเป็นขนาดแปลงละ 1X2 เมตร การฉีดพ่น(ด้วยน้ำยาสับปะรด, น้ำยามะละกอ หรือน้ำเปล่า)จะสุ่มฉีดในแปลงทั้งหมดจำนวน 9 แปลง ได้แก่ น้ำยาและน้ำเปล่า 3 แปลง X 3 ครั้ง และแต่ละครั้งจะฉีดพ่นในแปลงที่มีวัชพืชเป็นเวลา 1 นาทีในปริมาณ 500 มล./ม2. ท่านสามารถดูเพิ่มเติมได้ที่ สารเอคโค เอเชียฉบับที่ 26]
วิธีใช้กระดาษกรอง
วิธีทดสอบแบบแรกนี้ไม่มีขั้นตอนยุ่งยากมากนัก แต่จะใช้เวลาหลายอาทิตย์กว่าจะเห็นผล มีการใช้อุปกรณ์หรือเครื่องมือน้อยกว่าแบบที่สอง และข้อมูลที่ได้อาจเป็นทั้งเชิงคุณภาพหรือปริมาณ วิธีใช้กระดาษกรองนี้ไม่ได้นับจำนวนจุลินทรีย์โดยตรง แต่จะวัดอัตราการย่อยสลายของอินทรีย์วัตถุ เนื่องจากจะต้องมีจุลินทรีย์ในการย่อยสลาย ดังนั้นจึงมีความสัมพันธ์กันโดยตรงระหว่างประชากรจุลินทรีย์และอัตราการย่อยสลาย ประชากรจุลินทรีย์มีผลทำให้การย่อยสลายเพิ่มขึ้น เช่นเดียวกับอัตราการสลายตัวของกระดาษกรอง (ส่วนปัจจัยแวดล้อมอื่นๆของจุลินทรีย์ เช่นอุณหภูมิและความชื้นในดินอาจมีผลต่ออัตราการย่อยสลายด้วยเช่นกัน)
วัสดุที่ใช้:
- กระดาษกรอง (ที่กรองกาแฟ หรือกระดาษกรองในห้องทดลองเช่นยี่ห้อ Whatman)
- ถุงตาข่าย (เราใช้ถุงที่ใช้ในเครื่องซักผ้า)
- พลั่ว
- เครื่องหมายติดที่แปลง (อาจเป็นธง, ริบบิ้นพลาสติก หรือกิ่งไม้)
- เทปวัดระยะ
วิธีการ:
- เริ่มด้วยมือที่สะอาดและถุงตาข่ายสะอาด
- ชั้งน้ำหนักกระดาษกรอง 1 ถึง 3 ชิ้น และใส่ไว้ในถุง โดยไม่ใช้กระดาษซ้อนกัน (กระดาษที่ใส่เพิ่มเข้าไปเพียงเป็นการทำซ้ำ) (ภาพที่ 1)

ภาพที่ 1: วิธีใช้กระดาษกรอง บรรจุกระดาษกรองไว้ในถุงตาข่ายเหมือนในรูป
- ในพื้นที่ทดลองแต่ละแปลงที่จะทำการติดตามดูจำนวนประชากรจุลินทรีย์ ให้ขุดหลุมขนาดเท่ากับขนาดของถุงที่ความลึกประมาณ 4-6 ซม. โดยให้ก้นหลุมเป็นแนวราบ
- วางถุงที่มีกระดาษกรองอยู่ข้างในไว้ในหลุม แล้วเอาดินที่ขุดขึ้นมากลบไว้ ให้ดินที่ปากหลุมพอดีกับดินส่วนอื่นในแปลง
- ทำเครื่องหมายจุดนั้นไว้เพื่อสามารถกลับมาหาเจออีกครั้ง
- ทิ้งไว้เป็นเวลา 6 อาทิตย์
- หลังจาก 6 อาทิตย์ ให้ขุดถุงขึ้นมาและเปรียบเทียบกระดาษกรองที่ถูกย่อยสลายไปในแต่ละแปลง (สามารถสังเกตด้วยตา โดยกะดูด้วยสายตาว่าอันไหนถูกย่อยสลายไปมากหรือน้อยที่สุด หากต้องการเปรียบเทียบให้ละเอียดถูกต้องให้ทำตามขั้นตอนที่ 8)
- สำหรับการวัดอัตราการย่อยสลายให้ละเอียดถูกต้องมากขึ้น ให้นำกระดาษกรองออกมาจากถุง เอาเศษดินออก (ถ้ามีก้อนดินติดอยู่ที่กระดาษ ให้เอาออกด้วยความระมัดระวัง) อบกระดาษกรองให้แห้งในเตาอบที่ตั้งอุณหภูมิไว้ที่ 60°C เป็นเวลา 24 ชม. เมื่อแห้งดีแล้ว นำกระดาษกรองนั้นไปชั่งน้ำหนัก โดยสูตรด้านล่างนี้จะใช้คำนวนน้ำหนักสุดท้ายที่เปลี่ยนไป ถ้าเปอร์เซนต์การย่อยสลายน้อยแสดงว่าเกิดการย่อยสลายน้อยด้วยและความแข็งแรงของจุลินทรีย์กับปริมาณจุลินทรีย์จะดูได้จากตัวเลขที่ได้นี้ ถ้าเปอร์เซนต์การย่อยสลายมากแสดงว่าปริมาณจุลินทรีย์มีอยู่มาก
วิธีตรวจนับโคโลนีของแบคทีเรีย้
การตรวจนับแบคทีเรียจะได้ข้อมูลที่เป็นตัวเลขในเวลาเพียง 24 ชั่วโมง

ภาพที่ 2: การทำอาหารเลี้ยงเชื้อและการนับโคโลนีแบคทีเรียเป็นวิธีหนึ่งในการชี้วัดการเปลี่ยนแปลงคุณภาพของระบบดิน
โดยแสดงถึงประชากรจุลินทรีย์ที่ปรากฏอยู่ในตัวอย่างที่เก็บมา (ภาพที่ 2) นอกจากส่วนที่เป็นรากพืช แมลงต่างๆทั้งขนาดเล็กและใหญ่ จุลินทรีย์ก็เป็นส่วนหนึ่งขององค์ประกอบทางชีวภาพของระบบดิน ห้องทดลองหลายแห่งใช้วิธีการนี้เพื่อวิเคราะห์ประชากรจุลินทรีย์ในดินเพื่อเป็นตัวชี้วัดถึงความเปลี่ยนแปลงคุณภาพของระบบดิน วิธีการนี้ต้องมีการเตรียมการและอุปกรณ์ที่มากกว่า แต่ผลที่ก็ได้จะแม่นยำกว่าด้วย การรักษาสภาพการทดลองให้ปลอดเชื้อเป็นสิ่งสำคัญมากที่จะทำให้ผลที่ได้จากการทดสอบวิธีนี้มีความถูกต้องแม่นยำ
สิ่งที่ต่างจากการทดลองในห้องทดลองส่วนใหญ่คือ เราทำวุ้นเลี้ยงเชื้อขึ้นมาเองและทำการอบจานเพาะเชื้อที่อุณหภูมิต่ำกว่าปกติเล็กน้อย (ที่ 27°C จากมาตรฐานที่ 25°C หรือ 30°C) ซึ่งหมายความว่าค่าตรวจนับจุลินทรีย์มาตรฐาน (CFU) จากห้องทดลองหรือต้นแบบการทดลองจะมีค่าต่างเล็กน้อยจากค่า CFU ที่เราได้ อย่างไรก็ตาม รูปแบบทั่วไปในการทดลองที่ผ่านมาคือการเพิ่มขึ้น การลดลงหรือการคงที่ของปริมาณจุลินทรีย์จะมีผลที่คล้ายกันกับที่ได้จากห้องทดลองอื่น เนื่องจากแบคทีเรียและเชื้อรามีความหลากหลายมาก ความต้องการสารอาหารของแต่ละสายพันธุ์จึงมีสัดส่วนต่างกันและไม่มีวุ้นเลี้ยงเชื้อเฉพาะชนิดใดจะสามารถใช้เลี้ยงจุลินทรีย์ทุกชนิดได้ บางชนิดอาจต้องการธาตุอาหารเสริมและสารประกอบอื่นเสริมเพื่อจะเพิ่มปริมาณได้อย่างมีประสิทธิภาพจนเป็นกลุ่มโคโลนีที่ตามองเห็นได้ และด้วยเหตุนี้ วุ้นเลี้ยงเชื้อของเราจึงสามารถนำมาใช้สำหรับแบคทีเรียและเชื้อราเพียงส่วนหนึ่งที่อยู่ในดิน แต่ก็ยังสามารถแสดงให้เห็นถึงทิศทางการเปลี่ยนแปลงโดยรวมของแบคทีเรียที่เติบโตจากวุ้นนั้น
อุปกรณ์ที่ใช้:
- พลั่วมือ
- เหยือก/ถุงใส่ตัวอย่างพลาสติก
- หลอดปีเปตขนาด 5 มล. (x2)
- หลอดทดลองขนาด 20 มล./ถ้วยแก้วขนาดเล็ก (x7)
- อาหารเลี้ยงเชื้อ (ทำเองได้ ดูวิธีทำด้านล่าง)
- แท่งคน
- แท่งเกลี่ยแบคทีเรีย
- แอลกอฮอล์/เปลวไฟ
[หมายเหตุ: อุปกรณ์วิทยาศาสตร์—อาหารเลี้ยงเชื้อ, หลอดทดลอง, แท่งคนและแท่งเกลี่ยแบคทีเรีย หาซื้อได้ที่ร้าน Union Science ถ.สุเทพ จ.เชียงใหม่]
วิธีการ:
- ทำเครื่องหมายไว้ที่หลอดทดลอง 7 หลอด และที่อาหารเลี้ยงเชื้อ 7 จาน ด้วยเครื่องหมาย “1, 10-1,10-2, 10-3, 10-4, 10-5, 10-6.” ทำการฆ่าเชื้อทั้งหมดด้วยการแช่ในสารละลายที่ประกอบด้วยน้ำ 9 ส่วนและน้ำยาฟอกขาว 1 ส่วน เป็นเวลา 24 ชั่วโมง หรือใส่ไว้ในหม้ออบแรงดันเป็นเวลา 20 นาทีที่อุณหภูมิ 121°C และที่แรงดัน 103.4 กิโลปาสคาล
- เติมหลอด 1 ด้วยน้ำที่ผ่านการฆ่าเชื้อแล้ว 10 มล. และเติมหลอดที่เหลืออยู่ทุกหลอดด้วยน้ำที่ผ่านการฆ่าเชื้อแล้วหลอดละ 9 มล.
- ใช้พลั่วมือที่ฆ่าเชื้อแล้วตักดินตัวอย่างในปริมาณอย่างน้อย 1 กรัม และใส่ไว้ในภาชนะที่ฆ่าเชื้อแล้ว
- ชั่งน้ำหนักดิน 1 กรัมแล้วใส่ลงไปในหลอด 1 ที่มีน้ำบริสุทธิ์อยู่ 10 มล.
- ผสมให้เข้ากัน (หากดินจับกันเป็นก้อน ให้ใช้ที่คนทำให้ก้อนดินให้แตกออก)
- ใช้หลอดปีเปตที่ฆ่าเชื้อแล้วดูดสารละลายดินออกมา 1 มล.จากหลอด 1 และนำไปใส่ในหลอด 10-1 คนให้เข้ากัน
- ใช้หลอดปีเปตเดียวกันนี้ดูดสารละลายดินออกมา 1 มล. จากหลอด 10-1 และนำไปใส่ในหลอด 10-2 คนให้เข้ากัน
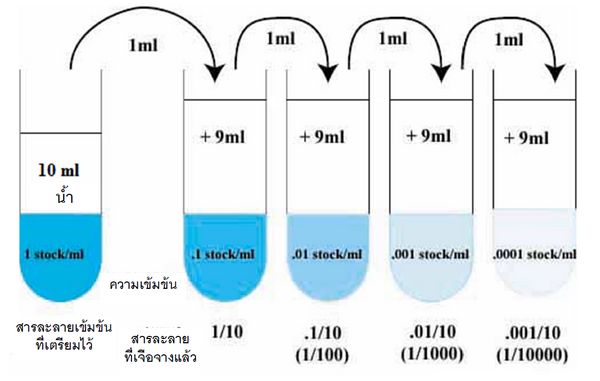
- ดูดสารละลาย 1 มล.จากหลอด 10-2 และนำไปใส่ในหลอด 10-3 ทำแบบเดียวกันนี้ตามลำดับเลข จนใส่สารละลายดินครบทุกหลอด (ภาพที่ 3)
ภาพที่ 3: การเตรียมสารละลายดินในความเข้มข้นระดับต่างๆเพื่อการตรวจนับโคโลนีจุลินทรีย์ - ฆ่าเชื้อแท่งเกลี่ยแบคทีเรีย โดยอาจนำไปลนไฟจนกลายเป็นสีแดงแล้วทิ้งให้เย็น หรืออาจเช็ดแท่งเกลี่ยด้วยเอธิลแอลกอฮอล์ 70% และทิ้งไว้ให้แห้ง
- ใช้หลอดปิเปตที่ฆ่าเชื้อแล้วหลอดที่สอง ดูดสารละลาย 0.5 มล.จากหลอด 10-6 ไปใส่บนจานเลี้ยงเชื้อ 10-6
- ใช้แท่งเกลี่ยที่ฆ่าเชื้อแล้วเกลี่ยสารละลายให้ทั่วจานจากขอบหนึ่งไปอีกขอบหนึ่ง เอียงจานในระดับ 90 องศาและให้สารละลายกระจายออก เอียงจานอีกสองครั้งเพื่อให้แน่ใจว่าสารละลายกระจายไปทั่ว (ภาพที่ 4) จากนั้นให้ปิดจานไว้อีกครั้งทันที

ภาพที่ 4: วิธีการกระจายแบคทีเรียที่ใส่ลงไปในจานเลี้ยงเชื้อ
- ฆ่าเชื้อแท่งเกลี่ย จากนั้นนำสารละลายปริมาณ 0.5 มล. จากหลอดที่ 10-5 ใส่ลงในจานที่ 10-5 เกลี่ยออกในลักษณะเดียวกับที่อธิบายไว้ในข้อที่ 11
- ทำซ้ำในขั้นตอนที่ 10 ถึง 12 สำหรับหลอดทดลอง/จานเลี้ยงเชื้อที่เหลือ ตามลำดับตัวเลข และจากหมายเลข 10-6 ไปยัง 10-1

ภาพที่ 5: ตัวอย่างของปัญหาที่มักเกิดขึ้นเมื่อทำรอย (streak)ในจาน ทั้งสองภาพนี้เป็นปัญหาจากการปนเปื้อนหรือความหนาแน่นของแบคทีเรียที่มากเกินไป ภาพทางซ้ายมีเส้นหนาจนทำให้นับไม่ได้ ส่วนภาพขวาโคโลนีหลายๆโคโลนีมารวมกันทำให้เห็นว่าบางจุดมีขนาดใหญ่มาก
- วางจานเพาะเชื้อคว่ำลงและเรียงเป็นชั้นเก็บไว้ในช่องอุณหภูมิอุ่น (เอคโคใช้ตู้เพาะเมล็ดที่สร้างขึ้นเอง ท่านสามารถเข้าไปดูรายละเอียดได้ที่ [https://www.youtube.com/watch?v=k6lux5EVUuI] ซึ่งเป็นวิดิโอ YouTube อธิบายขั้นตอนการทำไว้) เป็นเวลา 24 ชั่วโมงที่อุณหภูมิ 27°C
- หลังจากที่อบไว้เป็นเวลา 24 ชั่วโมงแล้ว ให้หาจานที่มีโคโลนี 30-300 โคโลนี แล้วนับจำนวนจุด(โคโลนี) ที่เห็นได้ชัดเจน ที่อาจจะมีรูปร่าง ขนาด และสีที่ต่างกันไป (ภาพที่ 2) อย่าลืมสังเกตว่า “โคโลนี” เป็นเพียงเส้นหนาที่เราได้ขีดเป็นรอยไว้ หรือหลังจากเพียง 24 ชั่วโมง “โคโลนี” เกิดขึ้นกินพื้นที่เป็นวงกว้างในจาน ซึ่งอาจเป็นเพราะสารละลายไม่เจือจางพอ หรือเครื่องมืออาจติดเชื้อ แทนที่เซลล์ที่มีอยู่ก่อนจะสร้างโคโลนีเพียงโคโลนีเดียว แต่กลับมีหลายโคโลนีที่โตขึ้นพร้อมกันและทำให้ยากต่อการนับให้ได้ผลที่ถูกต้อง (ภาพที่
CFU คือค่าประมาณของจำนวนจุลินทรีย์ที่มีชีวิต(แข็งแรง)ในปริมาณตัวอย่างที่ได้มา เซลล์แต่ละเซลล์ของแบคทีเรียหรือเชื้อราสามารถแบ่งตัวเองและทำให้เกิดเป็นโคโลนีที่มองเห็นได้ โดยทั่วไปแล้ว ค่า CFU จึงรายงานผลออกมาเป็น CFU/มล. ค่า CFU ที่สูงกว่าแสดงว่ามีปริมาณจุลินทรีย์มากกว่าในตัวอย่างที่มีค่า CFU ต่ำ ส่วนใหญ่ค่าการเจือจางของจุลินทรีย์ในดินที่ทำในห้องทดลองจะมีผลการนับออกมาอยู่ที่ระหว่าง 104 ถึง 1012 CFU สำหรับดิน 1 กรัม แต่ค่าที่ถือว่าเป็นค่าปกติจะมีความแตกต่างกันไป ขอความกรุณาอย่าลืมว่าวิธีที่เราทำอยู่นี้ แม้ในเชิงปริมาณ จะมีไว้เพื่อเป็นการแสดงค่าที่ได้ไปในทิศทางโดยรวมในแหล่งที่มาของดินที่หนึ่ง มากกว่าที่จะได้ค่ามาจำนวนหนึ่งเพื่อนำไปเปรียบเทียบกับดินจากแหล่งที่มาอื่นๆ นอกจากนี้องค์ประกอบและขนาดประชากรของจุลินทรีย์ในดินยังมีความแตกต่างกันไปตามความลึกและแหล่งที่มาด้วย
เนื่องจากข้อคำนึงเรื่องความปลอดภัย อย่าลืมว่ามีความเป็นไปได้ที่การใช้วิธีนี้จะทำให้แบคทีเรีย/เชื้อราที่เป็นพิษหรือก่อโรคเติบโตได้ และเพื่อลดความเป็นไปได้นี้จึงไม่ควรเก็บรักษาโคโลนีไว้ในที่อุณหภูมิสูงกว่าอุณหภูมิห้องในช่วงเวลาการบ่ม (โดยเฉพาะอย่างยิ่ง ควรหลีกเลี่ยงช่วงระยะอุณหภูมิ 36 ถึง 38°C เพื่อป้องกันการมีชีวิตอยู่และแพร่พันธุ์ของแบคทีเรียที่มักอาศัยอยู่ในสัตว์เลี้ยงลูกด้วยนม)
การทำวุ้นเลี้ยงเชื้อ

ภาพที่ 6: อุปกรณ์ที่ใช้ในการทำจานวุ้นเพาะเชื้อ ได้แก่ น้ำตาล ซุปก้อน ผงวุ้น และน้ำ
อุปกรณ์ที่ใช้:
- จานเพาะเชื้อ 12 จาน
- น้ำ 2 ถ้วย
- ผงวุ้น 2 ช้อนโต๊ะ
- ซุปหมูก้อน 2 ก้อน
- น้ำตาล 4 ช้อนโต๊ะ
- ขวด flaskที่มีความจุสองเท่าของของเหลวที่จะใช้ (เพื่อฆ่าเชื้อ)
- หม้อต้มแรงดัน
- เทอร์โมมิเตอร์ (ฆ่าเชื้อแล้ว)
- อลูมิเนียมฟอยล์
วิธีการทำ:
- นึ่งจานในหม้อต้มแรงดันเป็นเวลา 20 นาที ที่อุณหภูมิ 121°C และแรงดัน 103.4 กิโลปาสคาล หรือแช่ในสารละลายที่มีน้ำ 9 ส่วนและน้ำยาฟอกขาว 1 ส่วนเป็นเวลา 24 ชั่วโมง
- ผสมผงวุ้น, ซุปก้อน, น้ำตาล และน้ำ ในขวด flask ที่สามารถจุของเหลวนี้ได้สองเท่า ใส่ไมโครเวฟหรืออุ่นบนเตาจนส่วนผสมละลายจนหมด คนให้ทั่วเพื่อไม่ให้มีก้อนเหลืออยู่
- ปิดฝาขวดด้วยแผ่นฟอยล์ จากนั้นเอาไปวางในหม้อต้มแรงดัน ทำตามข้อแนะนำของหม้อต้มแรงดัน เพื่อให้ความร้อนอยู่ที่ 121°C และแรงดัน 103.4 กิโลปาสคาล เป็นเวลา 20 นาที
- ยกขวด flask ออกจากหม้อต้มแรงดัน แล้วรอจนอุณหภูมิอยู่ที่ 45°C
- เทส่วนผสมผงวุ้นลงในจานเลี้ยงเชื้อ ต้องแน่ใจว่าให้ส่วนผสมผงวุ้นอยู่ทั่วก้นจาน และอย่าเติมลงไปให้สูงเกินครึ่งหนึ่งของจาน
- ปิดฝาจานทุกจานทันที แล้วปล่อยให้ผงวุ้นเย็นตัว เมื่อวุ้นแข็งแล้ว ให้วางจานคว่ำลง
หรือมีอีกวิธีหนึ่งถ้าไม่ต้องการจะใช้ผงวุ้นทันที:

- ทำตามข้อ 2 และ 3 สำหรับผงวุ้น แต่ใช้ขวดแก้วที่มีฝาปิดและฆ่าเชื้อแล้ว หลังจากผงวุ้นได้รับการฆ่าเชื้อแล้ว ให้ลดแรงดันในหม้อต้มแล้วปิดฝาขวด วุ้นจะแข็งตัวและสามารถเก็บไว้ได้ 1 อาทิตย์
- เมื่อต้องการนำมาใช้ ให้วางขวดที่มีวุ้นอยู่เต็มนี้ไว้ในน้ำอุ่น (ไม่ใช่น้ำเดือด) จนกว่าวุ้นจะละลายและอุณหภูมิอยู่ที่ 45°C
- ทำตามข้อ 5 และ 6
ผลที่ได้
[บก.: เป้าหมายหลักของสารเอคโคเอเชียคือการนำเสนอทางเลือกให้กับเครือข่าย ในการการปรับปริมาณและเปรียบเทียบประชากรจุลินทรีย์ในดินเพื่อประเมินคุณภาพของดิน โดยเป็นส่วนหนึ่งของการทดลองภาพรวมที่ใหญ่กว่าในการทดสอบผลกระทบของน้ำยากำจัดวัชพืชจากธรรมชาติที่มีต่อวัชพืชและคุณภาพของดิน เราได้ทำการทดลองวิธีการสองอย่างนี้เพื่อดูแนวโน้มการก่อรูปโคโลนีในขบวนการทดลองเอคโค เอเชีย ที่เปรียบเทียบกับจำนวนจุลินทรีย์ในกระดาษกรองและกับผล CFU ที่ได้จากห้องทดลองจากผู้เชี่ยวชาญด้านการวิเคราะห์ดิน เอคโค เอเชียไม่ได้ทำการทดลองซ้ำให้เพียงพอที่จะได้ผลออกมาอย่างแม่นยำ เนื่องจากต้องการที่จะดูว่าในการเป็นองค์กร NGO ที่มีข้อจำกัดเราจะสามารถใช้ขบวนการทดลองที่ยอมรับได้แบบประหยัดค่าใช้จ่ายเพื่อให้เป็นตัวอย่างที่จะใช้พิจารณาคุณภาพของจุลินทรีย์ในดิน ดังนั้น แม้ข้อมูลต่อไปนี้เป็นข้อมูลตัวเลขแต่ผลที่ออกมานั้นเป็นที่เข้าใจในเชิงคุณภาพมากกว่าเชิงปริมาณ และสามารถนำไปใช้เพื่อเปรียบเทียบน้ำยาที่ใช้ภายใต้การทดลองเดียวกัน ไม่ใช่ข้ามการทดลอง เนื่องจากผลการทดลองที่ได้ขึ้นอยู่กับพื้นที่ที่มีภาวะแวดล้อมต่างกันของแปลงทดลอง อย่างไรก็ตาม เรายังเลือกที่จะรวบรวมผลที่ได้จากการทดลองนี้เพื่อแบ่งปันถึงสิ่งที่เราได้เรียนรู้กับสมาชิกในเครือข่ายก่อนที่พวกเขาจะทำการทดลองวิธีการเหล่านี้ด้วยตนเอง และเรายินดีที่จะรับฟังประสบการณ์ของท่าน ที่ท่านได้ทำการทดลองด้วยวิธีการอย่างหนึ่งอย่างใดที่เราได้นำเสนอ]
ในการทดลองด้วยกระดาษกรอง เราพบว่ากระดาษกรองมีข้อจำกัดต่อระยะเวลาที่เราทิ้งไว้ในดินมากกว่าที่เราคาดการณ์ไว้ อัตราการย่อยสลายอาจต่างกันไปตามสภาพอากาศและประเภทของดิน ถ้าท่านใช้วิธีการนี้เพื่อทำการทดลองเปรียบเทียบหรือศึกษาวิจัยเพื่อไว้ใช้เอง เราขอแนะนำว่าก่อนจะทดลองวัดปริมาณจุลินทรีย์ ให้ท่านลองฝังกระดาษกรองหลายๆอันไว้ในดินของท่านก่อน แล้วขุดเก็บมาทีละอันภายในระยะเวลาหลายๆอาทิตย์ เพื่อดูว่ากระดาษอยู่ในดินได้นานเท่าใดก่อนที่จะย่อยสลายหายไปหมด ท่านจะต้องมีสิ่งใดสิ่งหนึ่งเป็นตัววัดและเปรียบเทียบเพื่อถ้าหากเกิดการย่อยสลายมากกว่า 90% เราขอแนะนำให้ฝังดินไว้เป็นระยะเวลาสั้นลง เมื่อท่านได้วางกรอบการทำงานว่ากระดาษกรองจะอยู่ในดินได้นานเท่าใดแล้ว จึงค่อยเริ่มทำการทดลอง
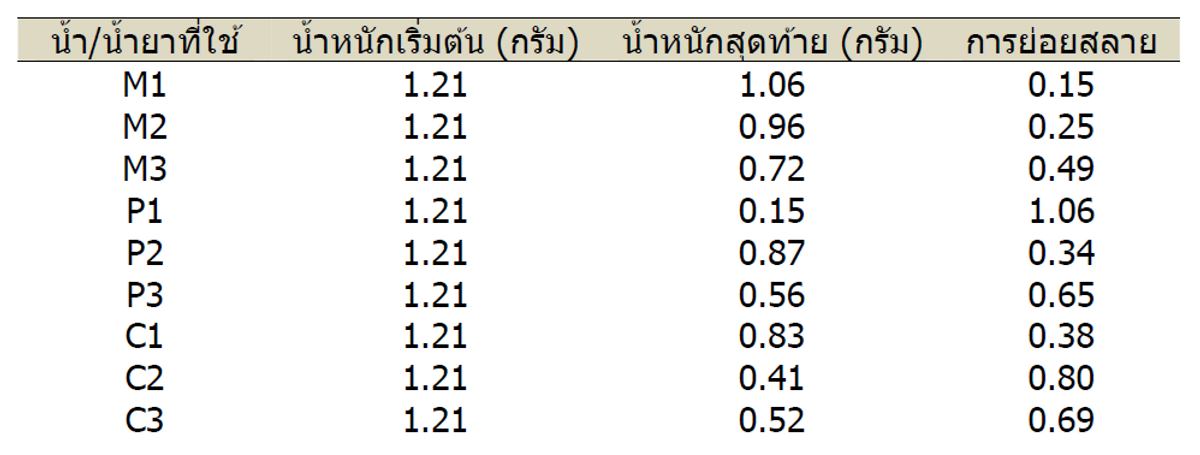
จากการทดลองของเราพบว่ามีสิ่งที่ไม่คาดคิดอยู่บ้าง ผลการทดลองทั้งสองอย่างทำให้เห็นความหลากหลายในดิน และความแตกต่างของรูปแบบในแง่ที่ว่าดินอันไหนยังคงเหมือนเดิมหรือเสื่อมสภาพลง การทดลองด้วยกระดาษกรองทำให้เห็นว่าแทบไม่มีความแตกต่างเลยระหว่างคุณภาพของจุลินทรีย์ในดินที่ได้รับน้ำ, น้ำยาสับปะรดหรือน้ำยามะละกอ (ตารางที่ 1) ความแตกต่างภายในการใช้น้ำยาชนิดเดียวกันมีมากกว่าระหว่างต่างชนิดกัน โดยเฉพาะแปลงที่ใช้น้ำยาสับปะรดและแปลงที่ใช้น้ำเป็นตัวเปรียบเทียบ แม้ว่าขนาดตัวอย่างจะเล็กเกินไปที่จะใช้เป็นข้อมูลสถิติ แต่เราก็สังเกตว่ากระดาษกรองที่ฝังไว้ในดินที่ใช้น้ำยามะละกอมีน้ำหนักที่หายไปน้อยที่สุดและมีการย่อยสลายช้ากว่ากระดาษกรองที่ฝังในดินที่ใช้น้ำยาสับปะรดและน้ำ ซึ่งแสดงว่าประชากรจุลินทรีย์อาจมีจำนวนลดลงในดินที่ใช้น้ำยามะละกอ
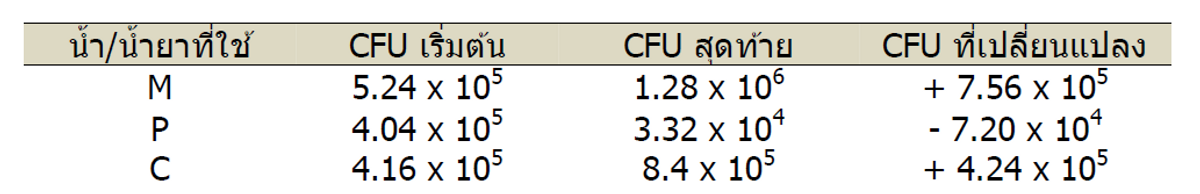
ในการทดสอบจานเลี้ยงเชื้อ ความแตกต่างของค่า CFU ในดินเริ่มต้นมีมากพอๆกับการเปลี่ยนแปลงของหน่วยก่อรูปโคโลนี ทำให้รูปแบบตายตัวนี้ยากต่อการเปรียบเทียบ ขณะที่ประชากรจุลินทรีย์ลดลงเมื่อมีการใช้น้ำยาสับปะรด ดินที่ใช้น้ำยามะละกอหรือน้ำกลับมีประชากรจุลินทรีย์เพิ่มขึ้น (ตารางที่ 2) มีบทความเขียนไว้ว่าค่า CFU จะลดลงต่ำกว่า 1.0 x 104 จากค่าตรวจนับโคโลนีเริ่มต้นถ้าน้ำยากำจัดวัชพืชมีผลในทางลบต่อสุขภาพของจุลินทรีย์ในดิน เราคิดว่าค่า CFU ที่เพิ่มขึ้นสำหรับมะละกอและน้ำอาจเป็นเนื่องจากฝนจากมรสุมที่เริ่มขึ้นในช่วงการทดลอง จึงทำให้เกิดความชื้นเพิ่มขึ้น หากมีการทดลองต่อไปด้วยการฉีดพ่นน้ำยากำจัดวัชพืชมากขึ้นอาจบอกเราได้ว่ารูปแบบที่ไม่คงที่นี้มีผลจากความเปลี่ยนแปลงระหว่างแปลงทดลอง หรือจากการที่ไม่มีความแตกต่างจริงๆระหว่างผลการใช้น้ำยาสองชนิดต่อสุขภาพของจุลินทรีย์ในดิน
สรุป
การทดสอบนี้สามารถช่วยเราในการประเมินขนาดประชากรจุลินทรีย์ในดินของเราได้ ดินแต่ละที่มีคุณสมบัติแตกต่างกันและมีประชากรจุลินทรีย์ที่แตกต่างกันด้วย การทดสอบนี้สามารถนำไปใช้ก่อนและหลังการใช้ปัจจัยการเกษตรใดๆใส่ลงในดินหรือการปรับปรุงดิน เพื่อประเมินถึงผลที่มีต่อสุขภาพของดิน หรืออาจนำไปใช้เพื่อเปรียบเทียบดินจากจุดต่างๆในพื้นที่การเกษตร โดยเฉพาะเมื่อมีความสงสัยว่ามีบางอย่างที่อาจส่งผลในทางที่ไม่ดีต่อจุลินทรีย์ในพื้นที่จุดในจุดหนึ่ง อย่างไรก็ตาม การทดสอบนี้สามารถบอกได้เพียงว่ามีผลกระทบหรือไม่เท่านั้น โดยไม่สามารถบอกได้ว่าอะไรคือปัจจัยสาเหตุที่ทำให้จำนวนจุลินทรีย์ลดลงหรือเพิ่มขึ้น โดยทั่วไปแล้ว ยิ่งดินมีคุณภาพดี จำนวนจุลินทรีย์ก็ยิ่งมีจำนวนมาก ซึ่งจะส่งผลต่อระบบการผลิตที่มีคุณภาพมากยิ่งขึ้น
หมายเหตุ: การทดสอบความชื้นของดิน, เนื้อดิน, และค่า pH ของดินสามารถดูได้ที่ ECHO Asia Note 15 “Soil Quality Assessment: Why and How” by Marcia Croft
อ้างอิง
Anderson, J. P. E. (1984). Herbicide degradation in soil: influence of microbial biomass. Soil Biology and Biochemistry, 16(5), 483-489.
Bünemann, E. K., Schwenke, G. D., & Van Zwieten, L. (2006). Impact of agricultural inputs on soil organisms—a review. Soil Research, 44(4), 379-406.
Hassink, J., Bouwman, L. A., Zwart, K. B., & Brussaard, L. (1993). Relationships between habitable pore space, soil biota and mineralization rates in grassland soils. Soil Biology and Biochemistry, 25(1), 47-55.
Hayat, R., Ali, S., Amara, U., Khalid, R., & Ahmed, I. (2010). Soil beneficial bacteria and their role in plant growth promotion: a review. Annals of Microbiology, 60(4), 579-598.
Lauber, C. L., Hamady, M., Knight, R., & Fierer, N. (2009). Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology, 75(15), 5111-5120.
Mendes, R., Kruijt, M., de Bruijn, I., Dekkers, E., van der Voort, M., Schneider, J. H., Piceno, Y.M., DeSantis, T.Z., Anderson, G.L., Bakker, P.A.H.M & Raaijmakers, J. M. (2011). Deciphering the rhizosphere microbiome for disease-suppressive bacteria. Science, 332(6033), 1097-1100.
Nicol, G. W., Leininger, S., Schleper, C., & Prosser, J. I. (2008). The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria. Environmental Microbiology, 10(11), 2966-2978.
Noll, M., Matthias, D., Frenzel, P., Derakshani, M., & Liesack, W. (2005). Succession of bacterial community structure and diversity in a paddy soil oxygen gradient. Environmental Microbiology, 7(3), 382-395.
Rao, N. S. S. (1995). Soil Microorganisms and Plant Growth (No. Ed. 3). Science Publishers, Inc.
Rietz, D. N., & Haynes, R. J. (2003). Effects of irrigation-induced salinity and sodicity on soil microbial activity. Soil Biology and Biochemistry, 35(6), 845-854.
Schnürer, J., Clarholm, M., Boström, S., & Rosswall, T. (1986). Effects of moisture on soil microorganisms and nematodes: a field experiment. Microbial Ecology, 12(2), 217-230.
Tisdall, J. M. (1994). Possible role of soil microorganisms in aggregation in soils. Plant and Soil, 159(1), 115-121.
Tourna, M., Freitag, T. E., Nicol, G. W., & Prosser, J. I. (2008). Growth, activity and temperature responses of ammonia-oxidizing archaea and bacteria in soil microcosms. Environmental Microbiology, 10(5), 1357-1364.
Van Bruggen, A. H. C., & Semenov A. M. (2000). In search of biological indicators for soil health and disease suppression. Applied Soil Ecology 15 (1), 13-24.